La prueba del carbono-14
La prueba del carbono-14 es probablemente el método de datación para objetos antiguos más conocido, y ciertamente se trata de un descubrimiento que resultó revolucionario para muchas disciplinas científicas, como por ejemplo la arqueología o la ciencia forense.
Es, sin embargo, aplicable solo a la datación de material orgánico, como organismos muertos (por ejemplo, las momias) u objetos hechos a partir materia orgánica (como podrían ser las telas o las pieles).
Como todos sabemos, los seres vivos tienen carbono en su organismo, pero este carbono no es siempre exactamente igual, y se encuentra en diferentes formas.
La más común de ellas es el carbono-12 y una de las menos abundantes es, precisamente, el carbono-14.
La cantidad de ambos se mantiene estable en el organismo mientras este se encuentra con vida, pero cuando este muere, mientras que el carbono-12 seguirá manteniéndose estable en los restos del organismo muerto, el carbono-14 empezará a desintegrarse y a desaparecer poco a poco.
El ritmo al que se desintegra el carbono-14 en la materia orgánica muerta es conocido, y es precisamente lo que se utiliza en el sistema de datación por carbono-14.
Aquí describiremos todo ello más en detalle.
Como hemos comentado, el carbono se encuentra presente en toda la naturaleza, y especialmente en los seres vivos.
También hemos dicho que se encuentra en diferentes formas, que en el caso del carbono serán tres: el carbono-12 (que es el más abundante), el carbono-13 y el carbono-14.
Este último es el que más nos interesará, ya que es el principal actor en la Prueba del carbono-14.
En primer lugar, vamos a ver que son exactamente las diferentes formas en que se presenta un elemento químico como el carbono.
Son lo que llamaremos ISÓTOPOS.
¿Y que son exactamente los isótopos?
Los elementos químicos vienen determinados por como son sus átomos.
Un átomo está formado por un núcleo compuesto por unas partículas relativamente grandes y otras partículas más pequeñas orbitando alrededor del núcleo.

En el núcleo podemos encontrar dos tipos de partículas, los protones, que tienen una carga eléctrica positiva, y los neutrones, que como su propio nombre indica no tienen carga.
Orbitando alrededor del núcleo encontraremos los electrones, mucho más pequeños y con carga negativa.

La cantidad de protones que tiene un átomo en su núcleo es lo que determina a que elemento químico pertenece, y es lo que conocemos como número atómico.
Por otro lado, cuando un átomo se encuentra en su estado más estable, el número de electrones girando alrededor del núcleo es el mismo que el de protones en el núcleo, de manera que las cargas positivas y negativas se compensan.
El átomo más sencillo que existe, por ejemplo, es el de hidrógeno, que tiene solo protón en el núcleo, y un solo electrón orbitando a su alrededor.
Puesto que solo tiene un protón, el número atómico del hidrógeno es 1.

Existen, sin embargo, otras dos formas del átomo de hidrógeno, que son el deuterio y el tritio, y la diferencia entre ellas son los neutrones que acompañan al protón del núcleo.
El deuterio tiene un neutrón adicional y el tritio dos.

Diremos, entonces que existen tres isotopos del hidrógeno: el hidrógeno común, también llamado protio, el deuterio y el tritio.
Como podemos ver, la presencia de neutrones no afecta al número atómico del átomo, pero son precisamente los responsables de que existan isótopos de un mismo elemento químico.
Esto nos lleva al otro dato importante en la descripción de los átomos y que nos permitirá diferenciar los isotopos de un mismo elemento, el número másico.
El número másico de un átomo es la suma protones y neutrones tiene en su núcleo.
En el hidrógeno, por ejemplo, tenemos tres números másicos, uno para cada isotopo:
- El hidrógeno común tendrá de número másico 1 (1 protón)
- El deuterio tendrá de número másico 2 (1 protón más un neutrón)
- El tritio tendrá de número másico 3 (1 protón más dos neutrones)
Con esto ya podemos entender los dos números principales que aparecen al lado de los símbolos de los elementos de la tabla periódica: el de arriba se refiere a su número atómico, y el de abajo nos indica su número másico.

Vemos el número másico que se indica en la tabla para el hidrógeno no es entero, y eso se debe a que es la media de los números másicos de los tres isotopos en relación con la cantidad de cada unos de ellos en la naturaleza, que como hemos visto podía ser 1, 2 o 3. En este caso es tan cercano a 1 que está claro que el isotopo más abundante es el que no tiene neutrones en el núcleo.
Si volvemos a los átomos de carbono, veremos que se presentan en forma de 3 isotopos, con número másicos de 12, 13 y 14, que en este caso se indicarán en el nombre del isótopo correspondiente.
- El carbono-12 (98,89 %)
- El carbono-13 (1,11 %)
- El carbono-14 que supone aproximadamente 1 parte por cada mil millones.
El carbono, en todas sus formas, tiene un número atómico de 6, por lo que todos isótopos tendrán 6 protones en el núcleo de sus átomos, y como el su isótopo más abundante es el carbono-12, vemos que su número másico es muy cercano a 12.

Por otro lado, el carbono-12 y el carbono-13 son elementos estables, mientras que el carbono-14 es lo que se conoce como un radioisótopo, lo que quiere decir que en condiciones normales se va desintegrando espontáneamente.
Aquí nos centraremos en el carbono-12 y el carbono-14.
En primer lugar, describiremos ambos isótopos:
El carbono-12, como su propio nombre indica, tiene un número másico de 12, por lo que tendrá 6 neutrones en el núcleo acompañando a los protones.
El carbono-14 tendrá un número másico de 14, por lo que tendrá un núcleo con 6 protones y 8 neutrones.

En el caso de la datación por carbono-14 nos interesará la proporción que existe entre estos dos isótopos.
Como hemos comentado anteriormente la cantidad de carbono-12 no varía, pero el carbono-14 es un isótopo radioactivo que tiende a ir desapareciendo gradualmente, sin embargo, la proporción carbono-12/carbono-14 se mantiene estable en la atmósfera.
Esto es posible porque en nuestra atmósfera, aunque se va desintegrando el carbono-14 también se va creando de nuevo de manera constante.
¿Y como se crea el carbono-14 en la atmósfera?
Los responsables son los rayos solares. Cuando estos impactan contra la atmósfera, lo hacen mediante diferentes partículas, entre las que se encuentran protones, electrones, y algunos neutrones, y estos neutrones, de vez en cuando impactan contra átomos de nitrógeno.
Los átomos de Nitrógeno tienen un número atómico de 7 y un número másico de 14, por lo que su núcleo estará compuesto por 7 protones y 7 neutrones.
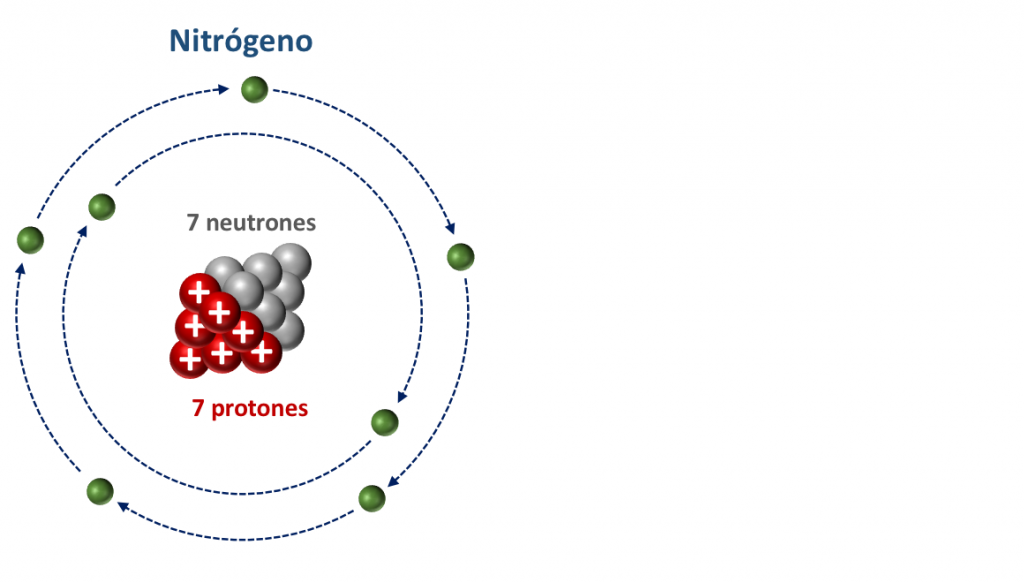
Al impactar contra el átomo de nitrógeno, el neutrón que proviene de los rayos solares se introduce en su núcleo expulsando a su vez a uno de los protones existentes.
A Partir de aquí nos centraremos solamente en los núcleos de los átomos, ya que es la parte esencial para entender la explicación y nos facilitará su representación gráfica.
Como podemos ver, en este proceso el átomo de nitrógeno gana un neutrón y pierde un protón.

De esta manera, el átomo resultante pasa a tener 6 protones y 8 neutrones en el núcleo, por lo que se convierte precisamente en un átomo de carbono-14.
Esta reacción se reproduce constantemente en la atmosfera, y es la que mantendrá estable la proporción la cantidad de carbono-14, y por tanto también la proporción carbono-12/carbono-14.
¿Y como llega el carbono-14 a los organismos vivos?
El carbono de la atmósfera, en todas sus formas, es absorbido por las plantas en su proceso de fotosíntesis, y estás son después ingeridas por animales y humanos, por lo que esta proporción de carbono-12/carbono-14 también se mantendrá constante dentro de los organismos vivos mientras vayan alimentándose.

Esto, sin embargo, cambia cuando el organismo muere. A partir de ese momento deja de alimentarse, y puesto que deja de renovar el carbono que tiene en su interior, la cantidad de carbono-12 se mantendrá estable en sus restos, pero la cantidad de carbono-14 empezará a desintegrarse poco a poco hasta desaparecer, ya que no es reemplazado por nuevo carbono-14.
Esta desintegración del carbono-14 en los organismos muertos es la clave en la datación por carbono-14.
En primer lugar describiremos el proceso de desintegración del carbono-14:
Se trata de un isótopo radioactivo del carbono, lo que significa que es inestable, por lo que su desintegración es, de hecho, una transformación hacia un elemento más estable.
En este caso, los átomos de carbono-14 sufren, más o menos, el proceso inverso a su creación, por lo que uno de sus neutrones se convierte en un protón
Debido a esto, el número atómico del átomo pasa de 6 a 7, convirtiéndose de nuevo en un átomo de Nitrógeno.
Este proceso se conoce como decaimiento beta y el átomo de carbono-14 pierde además un electrón.

¿Y a que velocidad se produce este proceso?
La tasa de decaimiento o desintegración de elementos radioactivos se calcula mediante lo que conocemos como semivida o período de semidesintegración.
Este valor es constante para cada elemento radioactivo, y es el tiempo necesario para que se desintegren la mitad de los átomos de una muestra inicial del radioisótopo.
Como podemos ver el decaimiento se produce en un porcentaje (50%) y no en una cantidad fija, y esto se debe al carácter aleatorio de la desintegración nuclear.
Para entenderlo mejor haremos una comparación que nos puede ayudar a ver como funciona.
Utilizaremos la fusión del hielo como símil de desintegración, y veremos que es diferente a la de los elementos radioactivos.
Si tenemos una cantidad determinada de cubitos de hielo, por ejemplo 100, estos NO se deshacen aleatoriamente, sino que se deshace una determinada cantidad en un tiempo determinado.
Por lo tanto, si en 20 minutos se deshacen la mitad de ellos (50 cúbitos), en los siguientes 20 minutos se desharán los restantes 50 cúbitos, de manera que tras dos semividas ya no quedará ninguno.
Vemos que cada periodo de semidesintegración sucesivo desaparece la misma cantidad de hielo, por lo que la desintegración del hielo seguiría una curva de este tipo:

En la desintegración de un elemento radioactivo, no desaparece una cantidad determinada en cada período de tiempo sino un tanto por ciento de la muestra.
Por ejemplo, si partimos de una cantidad inicial de un elemento radioactivo, en un periodo de semivida desaparecerá el 50% del elemento. En un segundo período de semivida, de nuevo desaparecerá la mitad del elemento, pero esta vez será la mitad de la cantidad restante por lo que es este caso será mucho menor.
Imaginemos que tenemos, por ejemplo, una cantidad de 100 unidades de un elemento radioactivo con un período de semivida de 20 años.
En los primero 20 años la muestra pasará de 100 a 50 unidades. (50% de 100)
En los siguientes 20 años pasará de 50 a 25 unidades. (50% de 50)
En los siguientes 20 años pasará de 25 a 12,5 unidades. (50% de 25)
En este caso vemos que la cantidad de elemento radioactivo que desaparece en cada período de semivida sucesivo es menor, por lo que la desintegración de un elemento radiactivo seguiría la siguiente curva:

Siguiendo la función observamos que cantidad de elemento radioactivo desciende constantemente, pero en realidad nunca desaparece del todo. Aun así, habrá un momento es que sea totalmente indetectable.
El decaimiento del carbono-14 seguirá por tanto una curva de este tipo, y puesto sabemos que su período de semidesintegración es de 5730 años, podemos añadir este dato al gráfico y obtener la curve de desintegración del carbono-14, donde N0 corresponderá a la cantidad inicial del radioisótopo.

Aquí tenemos la curva que describe el descenso en la cantidad de carbono-14 en un organismo desde el momento en que este muere.
Este cálculo se realiza comparando la cantidad de carbono-14 con la de carbono-12, ya que esta última se mantendrá siempre estable y será la misma que tenia el material orgánico en el momento de su muerte.

Para poder verlo en un ejemplo supondremos que las proporciones habituales de carbono-12 y carbono-14 en la atmosfera son mucho más manejables, lo que nos ayudará a entender los cálculos para la datación.
Imaginemos que la proporción estable en la atmósfera carbono-12/carbono-14 es de 100 a 1.
Si encontramos un organismo hace mucho tiempo, lo que haremos es medir sus cantidades de carbono-12 y de carbono-14.
Pongamos que esta medición nos da 300 gramos de carbono-12 y 1 gramo de carbono-14.
La cantidad de carbono-12 que tenía dicho organismo antes de morir era la misma que ahora, ya que se mantiene estable, y la cantidad de carbono-14 era un 1% de la de carbono-12, es decir, 3 gramos.
Si ahora solo queda 1 gramo de carbono-14, mediante la gráfica que tenemos podemos calcular hace cuanto tiempo que el carbono-14 empezó a desintegrarse, o lo que es lo mismo, cuanto tiempo lleva muerto el organismo en cuestión.
Vemos que 1 gramo es un tercio de la cantidad inicial de carbono-14:

Para hacer este cálculo simplemente debemos utilizar la fórmula de la curva de desintegración del carbono-14, que es:
N = N0*e-0,00012*t
Donde N0 es la cantidad inicial de carbono-14 que tenía el organismo cuando todavía estaba vivo, y N es la cantidad que hemos encontrado.
1 = 3*e-0,00012*t
Resolviendo la ecuación obtendremos el tiempo transcurrido desde que el carbono-14 empezó a desintegrarse, o lo que es lo mismo, desde que el organismo vivo murió.
Esta es la explicación básica para la datación por carbono-14, pero existen, sin embargo, algunas variables adicionales que debemos comentar.
En primer lugar, como hemos visto, a partir de cierto tiempo transcurrido la cantidad de carbono-14 restante en el organismo será indetectable, por lo que no podremos realizar la datación. Esto sucede aproximadamente a partir de los 58.000 o 60.000 años.
Esto significa que este sistema de datación solo funciona para organismos muertos hace menos de 60.000 años, como las momias o los restos de algunas antiguas civilizaciones, pero en ningún caso para datar, por ejemplo, restos de dinosaurios, ya que estos llevan extinguidos millones de años.

Para datar objetos más antiguos existen otros isotopos radioactivos con períodos de semivida mucho más largos, como el Uranio, que nos permite datar rocas con miles de millones de años de antigüedad.
También nos encontramos con otra dificultad, y se trata de que no sabemos exactamente si la proporción entre el carbono-12 y el carbono-14 que tenemos en la atmosfera actualmente es la misma que existía hace algunos miles de años, por lo que la curva de proporciones entre ambos isótopos debe ser calibrada.
Esto se hace mediante la dendrocronología, que es la cronología basada en el patrón de líneas concéntricas que encontramos en el interior de los troncos de los árboles.

Gracias al estudio de estas líneas se conoce perfectamente la edad de las diferentes capas del tronco de un árbol, por lo que mirando la proporción de carbono-12 y carbono-14 que tienen los arboles en esa zona, podemos verificar y corregir, en caso necesario, la curva de datación por carbono-14.
Por último, debemos remarcar que en los estudios de datación por carbono-14 nunca se utiliza como muestra la proporción entre ambos isótopos de la atmósfera actual, sino la que existía en 1950.
Esto se debe a que la contaminación de los últimos años, y sobre todo las pruebas nucleares realizadas en la segunda mitad del pasado siglo han desestabilizado totalmente la proporción entre los isotopos de carbono de la atmosfera, por lo que ya no es un valor fiable.